Такие сенсорные изменения, как нарушения восприятия вкуса и обоняния являются распространенным побочным эффектом лечения рака1 и могут увеличить риск потери массы тела и развития нутритивной недостаточности у онкологических пациентов 1-6.
В статье мы подробно расскажем о том, какие виды сенсорных изменений бывают у онкопациентов, почему эти изменения могут привести к потере веса и недостаточности питания, а также о том, как выбрать питание индивидуально для каждого пациента.
Насколько распространены сенсорные изменения у онкологических пациентов?

Изменения восприятия вкуса и обоняния могут возникать у пациентов со всеми видами злокачественных новообразований, до установления диагноза, вовремя и в течение 1 года после противоопухолевого лечения1. Они, как правило, усугубляются во время лечения: с распространенностью до 16–70% во время химиотерапии и до 50–70% во время лучевой терапии1.
Какие сенсорные изменения могут возникать у онкологических больных?
Изменения восприятия вкуса и обоняния являются характерными для онкологических заболеваний сенсорными изменениями, и могут сильно различаться по своему характеру и степени влияния на пациентов7. Хемосенсорные изменения могут включать гипо- или гиперчувствительность восприятия вкуса или запаха, искажение вкуса (дисгевзия) или вкусовое восприятие в отсутствие раздражителя (фантогевзия)7,8. Дисгевзия и развитие неприятного вкуса, такого как горький, химический, металлический или тошнотворный, считаются наиболее распространенными сенсорными изменениями при раке. Например, о металлическом привкусе сообщили 32% пациентов, проходящих химиотерапию и/или лучевую терапию, с различными видами опухолей; 4 и 16% больных раком легких в отдельном исследовании9.
Что вызывает сенсорные изменения у пациентов с онкозаболеваниями?
Причины сенсорных изменений у онкопациентов многофакторные, а лежащие в их основе механизмы не до конца изучены. Чаще всего изменения восприятия вкуса и запаха возникают как побочный эффект противоопухолевого лечения. Лучевая терапия и химиотерапия направлены на быстро делящиеся клетки, включая вкусовые и обонятельные рецепторы (и их предшественники/стволовые клетки), тем самым вызывая их цитотоксическое повреждение. Данные методы лечения могут также нарушать выработку слюны и слизи, косвенно влияя на вкус, вызывая развитие ксеростомии (сухость в полости рта) и мукозита слизистой оболочки полости рта и глотки1,10. Сенсорные изменения также могут быть частью сложных патофизиологических проявлений рака. Потенциальные механизмы включают системное воспаление, модификацию микробиоты кишечника, механическую обструкцию хеморецепторных участков, вмешательство опухоли в процесс передачи нервных импульсов и метаболические изменения1,10.
Почему важно учитывать изменение вкуса?
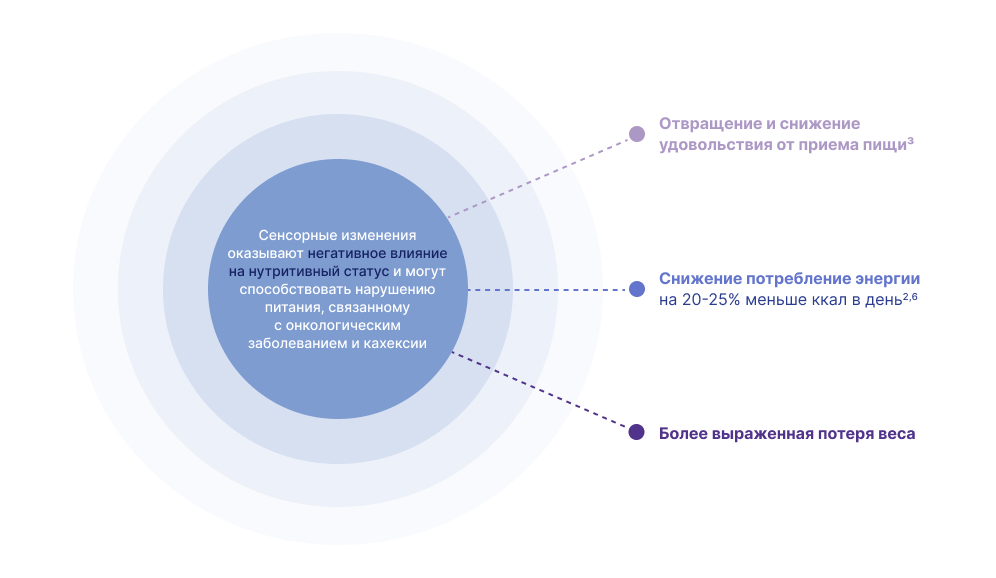
Вкусовые и сенсорные изменения являются недооцененным и неприятным побочным эффектом противоопухолевого лечения и могут иметь ряд медицинских и психосоциальных последствий. Наиболее существенным является то, что сенсорные изменения могут привести к потере массы тела и нутритивной недостаточности2,6. Сенсорные изменения также связаны с ухудшением социально-эмоциональной , эмоциональной, ролевой, физической функций и плохим общим качеством жизни11,12.
Что вызывает изменения вкуса при онкологических заболеваниях?
За восприятие вкуса отвечают примерно 5000 вкусовых рецепторов, расположенными на поверхности языка и во рту, которые распознают основные вкусы сладкого, кислого, соленого, горького2,3. Иногда изменения вкуса вызваны тем, что непосредственно сама опухоль нарушает нормальные процессы в организме2,3. Однако чаще всего этот эффект является непреднамеренным побочным эффектом противоопухолевого лечения. Как лучевая терапия, так и химиотерапия оказывают повреждающее действие на вкусовые рецепторы, влияя на восприятие вкуса пищи и напитков; они также могут влиять на сенсорные нервы, изменяя ощущения в ротовой полости2,3. Хирургическое лечение опухолей головы и шеи также может оказать влияние на восприятие вкуса и запаха, из-за анатомических изменений в носоглотке и полости рта.
Почему возникает ксеростомия при онкологических заболеваниях?
Противоопухолевое лечение, в_частности химиотерапия и лучевая терапия, может приводить к развитию сухости во рту из-за уменьшения количества вырабатываемой слюны. Поскольку слюна помогает рецепторам воспринимать вкус, сухость во рту может повлиять на его восприятие. Ксеростомия также может быть причиной инфекции ротовой полости, боли в горле и даже кариеса2,3.
Как изменение восприятия вкуса может увеличить риск развития нутритивной недостаточности?
Сенсорные изменения могут привести к проблемам с питанием, таким как отвращение к пище и снижение разнообразия пищи, а также к снижению приверженности пациентов к выполнению рекомендаций по питанию13-16. У пациентов с инверсией вкуса часто отмечается снижение аппетита и снижение потребления энергии и питательных веществ, что может отрицательно сказаться на нутритивном статусе и привести к потере массы тела2-7,17.
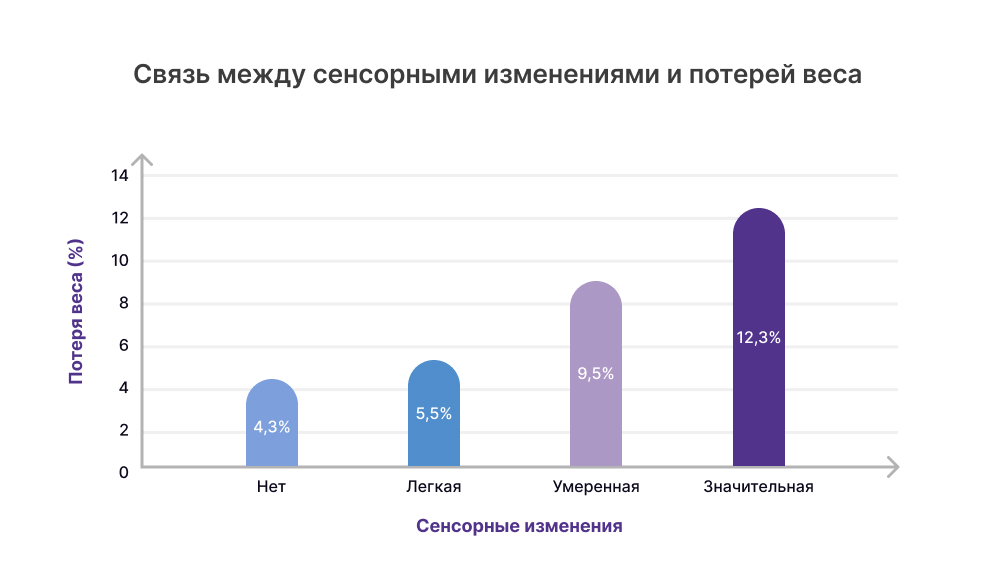
В исследовании пациентов с распространенным раком, получающих химиотерапевтическое лечение, пациенты с сенсорными изменениями потребляли на 20–25% меньше калорий в день, а их средняя потеря веса за 6 месяцев увеличивалась пропорционально тяжести хемосенсорных изменений2. Потеря массы тела увеличилась с 4,3% у пациентов без изменения восприятия вкуса или обоняния до 5,5%, 9,0% и 12,3% у пациентов с легкой, умеренной и тяжелой выраженностью инверсии вкуса, соответственно2.
Каковы последствия потери массы тела у онкологических больных?
Потеря массы тела у пациентов больных раком вызывает особое беспокойство, поскольку недостаточность питания и кахексия являются предикторами плохих клинических исходов. Нутритивная недостаточность связана с повышенной заболеваемостью и смертностью, повышенным риском развития осложнений, снижением переносимости химио- и лучевой терапии и ухудшением качества жизни18,19. По этим причинам крайне важно начать корректировать недостаточность питания как можно раньше у пациентов с онкологическими заболеваниями и обеспечивать для них оптимальную нутритивную поддержку.
В каких случаях следует использовать нутритивную поддержку и специализированное энтеральное питание?
У онкопациентов с нутритивной недостаточностью или с риском её развития, которые могут принимать пищу, Европейское общество клинической онкологии (ESMO) рекомендует консультирование по вопросам питания в качестве первого шага нутритивной поддержки для улучшения перорального приема пищи и стимулирования набора массы тела20. Консультации по питанию должны проводиться квалифицированным специалистом с акцентом на потреблении белка, увеличенном количестве приемов пищи в день, а также лечении симптомов, негативно влияющих на прием пищи, с помощью дополнительного питания при его необходимости. Руководство ESMO также рекомендует использование дополнительного перорального питания (сипинг) как часть диетотерапии для улучшения потребления энергии и стимулирования набора массы тела, если обычного питания недостаточно. Нажмите, чтобы ознакомиться с полным текстом рекомендаций ESMO по лечению кахексии у онкологических больных20.
Почему важно учитывать сенсорные изменения при назначении сипинга?
Успех применения сипинга в отношении улучшения нутритивного статуса и клинических исходов лечения зависит от комплаентности пациента21,22. Но достижение высокого уровня комплаентности при приеме дополнительного перорального питания может быть сложной задачей, если за счет хемосенсорных изменений определенные вкусы и текстуры становятся неприятными. Переносимость и приятный вкус специализированного питания являются важными факторами в соблюдении пациентами режима приема дополнительного питания23,24; таким образом, оптимизация вкусовых качеств и переносимости сипингов является важной стратегией для повышения приверженности пациентов и увеличении шансов на успех противоопухолевой терапии.
Как Нутридринк Компакт Протеин учитывает изменение нарушения вкуса?
Нутридринк Компакт Протеин включает в себя особенную линейку из трех специально разработанных вкусов, предназначенных для нутритивной поддержки онкопациентов с инверсией вкуса.
- Spotten LE, et al. Ann Oncol. 2017;28:969-84.
- Brisbois TD, et al. J Pain Symptom Manage. 2011;41:673-83.
- Boltong A, et al. Support Care Cancer. 2012;20:2765-74.
- McGreevy J, et al. Support Care Cancer. 2014;22:2635-44.
- Turcott JG, et al. Nutr Cancer. 2016;68:241-9.
- Belqaid K, et al. Acta Oncol 2014;53:1405-12.
- Drareni K, et al. Semin Oncol. 2019;46:160-72.
- Hummel T, et al. GMS Curr Top Otorhinolaryngol Head Neck Surg.
- 2011;10:Doc04,
- Sarhill N, et al. Support Care Cancer. 2003;11:652-9.
- Murtaza B, et al. Front Physiol. 2017;8:134.
- Alvarez-Camacho M, et al. Qual Life Res. 2016;25:1495-504.
- de Vries YC, et al. Supportive Care Cancer. 2016;24:3119-26.
- Ravasco P. Eur J Oncol Nurs. 2005;9 Suppl 2:S84-S91.
- Coa KI, et al. Nutr Cancer. 2015;67:339-53.
- van Bokhorst-de van der Schueren MA, et al. Eur J Oncol Nurs. 2005;9Suppl 2:S74-83.
- Skolin I, et al. Support Care Cancer. 2006;14:369-78.
- Bressan V, et al. Support Care Cancer. 2017;25:1699-712.
- Ryan AM, et al. Nutrition 2019;67-68:110539.
- Van Cutsem E, Arends J. Eur J Oncol Nurs. 2005;9 Suppl 2:S51-63
- Arends J, et al. ESMO Open. 2021;6:100092.
- Hubbart et al. 2012 Clin Nutr 31(3):293-312
- De van der Schueren et al. Ann Oncol. 2019;29(5):1141-53
- Lidoriki I, et al. J Am Coll Nutr. 2020;39:650-6.
- Hogan SE, et al. Support Care Cancer. 2019;27:1853-60.
- Ryan et al. Proc Nutr Soc. 2016;75(2):199-211.
- Fearon K et al. Lancet Oncol, 2011;12(5):489-95.
- Capuano G, et al. Head Neck 2008;30:503-8.
- Andreyev HJ, et al. Eur J Cancer, 1998;34:503-9.
- Rickard KA, et al. Cancer 1983;52:587-98.
- Andreyev HJ et al. Eur J Cancer. 1998;34(4)p.503-9.
- Prado CM, et al. Cancer Chemother Pharmacol, 2011; 67(1): p.93-101.
- Fearon KC. Eur J Cancer 2008;44(8): p.1124-32



